IPTG (isopropyl-β-D-thiogalactoside) הוא אנלוגי של מצע β-galactosidase, אשר ניתן להשררה מאוד.תחת אינדוקציה של IPTG, המשרה יכול ליצור קומפלקס עם חלבון המדכא, כך שהקונפורמציה של חלבון המדכא משתנה, כך שלא ניתן לשלב אותו עם גן המטרה, וגן המטרה יבוא לידי ביטוי ביעילות.אז איך צריך לקבוע את ריכוז ה-IPTG במהלך הניסוי?האם כמה שיותר גדול יותר טוב?
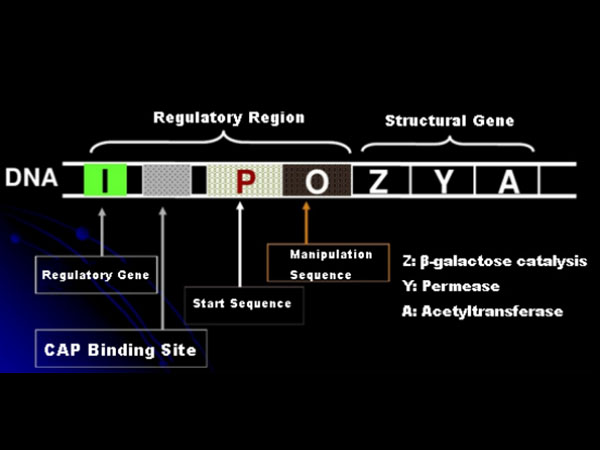
ראשית, בואו נבין את העיקרון של אינדוקציה של IPTG: אופרון הלקטוז (אלמנט) של E. coli מכיל שלושה גנים מבניים, Z,Y ו-A, המקודדים ל-β-galactosidase, permease ו-acetyltransferase, בהתאמה.lacZ מבצע הידרוליזה של לקטוז לגלוקוז וגלקטוז, או לאלו-לקטוז;lacY מאפשר ללקטוז בסביבה לעבור דרך קרום התא ולחדור לתא;lacA מעביר את קבוצת האצטיל מאצטיל-CoA ל-β-galactoside, הכרוך בהסרת האפקט הרעיל.בנוסף, ישנו רצף הפעלה O, רצף התחלתי P וגן רגולטורי I. קוד הגן I הוא חלבון מדחיק שיכול להיקשר למיקום O של רצף המפעילים, כך שהאופרון (מטא) מודחק ו כבוי.קיים גם אתר קישור לאתר הקישור חלבון-CAP של מפעיל גנים קטבוליים במעלה הזרם של רצף ההתחלה P. רצף ה-P, רצף ה-O ואתר הקישור של ה-CAP מהווים יחד את האזור הרגולטורי של האופרון lac.הגנים המקודדים של שלושת האנזימים מוסדרים על ידי אותו אזור רגולטורי כדי להשיג ביטוי מתואם של תוצרי גנים.
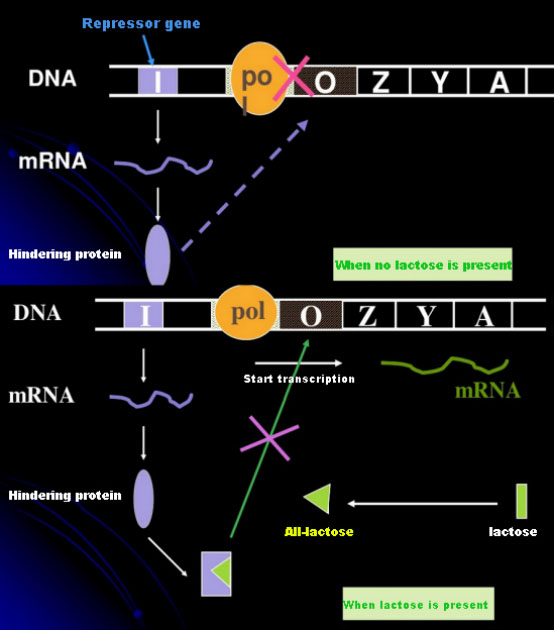
בהיעדר לקטוז, ה-lac operon (meta) נמצא במצב של הדחקה.בשלב זה, ה-lac repressor המתבטא על ידי רצף I בשליטה של רצף פרומטור PI נקשר לרצף O, מה שמונע מ-RNA פולימראז להיקשר לרצף P ומעכב את התחלת שעתוק;כאשר קיים לקטוז, ניתן לגרום ל-lac operon (meta) במערכת האופרון (meta) זו, הגורם האמיתי אינו הלקטוז עצמו.לקטוז חודר לתא ומזרז על ידי β-galactosidase להמרה לאלולקטוז.האחרון, כמולקולת מעורר, נקשר לחלבון המדכא ומשנה את מבנה החלבון, מה שמוביל לניתוק החלבון המדכא מרצף ה-O ותעתוק.ל-Isopropylthiogalactoside (IPTG) השפעה זהה לאלולקטוזה.זהו גורם חזק מאוד, שאינו עובר חילוף חומרים על ידי חיידקים והוא יציב מאוד, ולכן נעשה בו שימוש נרחב במעבדות.
כיצד לקבוע את הריכוז האופטימלי של IPTG?קח את E. coli כדוגמה.
הזן E. coli BL21 המהנדס גנטית המכיל את pGEX רקומביננטי חיובי (CGRP/msCT) חוסן לתוך מדיום נוזלי LB המכיל 50μg·mL-1 Amp, ותופח למשך הלילה ב-37°C.התרבית הנ"ל חוסנה ל-10 בקבוקים של מדיום נוזלי LB טרי של 50 מ"ל המכיל 50μg·mL-1 Amp ביחס של 1:100 לתרבית הרחבה, וכאשר ערך OD600 היה 0.6~0.8, הוסף IPTG לריכוז הסופי.זה 0.1, 0.2, 0.3, 0.4, 0.5, 0.6, 0.7, 0.8, 0.9, 1.0 mmol·L-1.לאחר אינדוקציה באותה טמפרטורה ובאותה זמן, נלקח ממנו 1 מ"ל מתמיסת החיידקים, ותאי החיידק נאספו בצנטריפוגה והועברו ל-SDS-PAGE כדי לנתח את ההשפעה של ריכוזי IPTG שונים על ביטוי חלבון, ולאחר מכן בחר את ריכוז ה-IPTG עם ביטוי החלבון הגדול ביותר.
לאחר ניסויים, יתברר שריכוז ה-IPTG אינו גדול ככל האפשר.הסיבה לכך היא של-IPTG יש רעילות מסוימת לחיידקים.חריגה מהריכוז תהרוג גם את התא;ובאופן כללי, אנו מקווים שככל שהחלבון מסיס יותר מבוטא בתא, כן ייטב, אך במקרים רבים כאשר ריכוז ה-IPTG גבוה מדי, תיווצר כמות גדולה של הכללה.גוף, אבל כמות החלבון המסיס ירדה.לכן, ריכוז ה-IPTG המתאים ביותר הוא לרוב לא ככל שהריכוז גדול יותר טוב יותר, אלא ככל שהריכוז נמוך יותר.
מטרת האינדוקציה והגידול של זנים מהונדסים גנטית היא להגדיל את התפוקה של חלבון המטרה ולהפחית עלויות.הביטוי של גן המטרה לא מושפע רק מגורמי הזן עצמו ומפלסמיד הביטוי, אלא גם מתנאים חיצוניים אחרים, כמו ריכוז הגורם המשרה, טמפרטורת האינדוקציה וזמן האינדוקציה.לכן, באופן כללי, לפני ביטוי ומטהרת חלבון לא ידוע, עדיף ללמוד את זמן האינדוקציה, הטמפרטורה וריכוז ה-IPTG על מנת לבחור את התנאים המתאימים ולהשיג את תוצאות הניסוי הטובות ביותר.
זמן פרסום: 31 בדצמבר 2021

